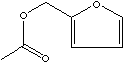
PRODUCT IDENTIFICATION
H.S. CODE
TOXICITY
CLASSIFICATION
PHYSICAL AND CHEMICAL PROPERTIES
MELTING POINT
SOLUBILITY IN WATER
REFRACTIVE INDEX
65 C
APPLICATIONS
Furfuryl Acetate is used as a solvent and flavor enhancer and modifier in foods and perfumes.
APPEARANCE
ASSAY
98.0% min
ACIDITY
0.1% max
FEMA No.: 2490
Polarity
The most common solvent is water. Other common solvents which dissolve substances that are insoluble (or nearly insoluble) in water are acetone, alcohol, formic acid, acetic acid, formamide. BTX, carbon disulfide, diemthyl sulfoxide, carbon tetrachloride, chloroform, ether, tetrahydrofuran, furfural, hexane and turpentine. They may be classified as polar and non-polar. Polar solvents, like water, have molecules whose electric charges are unequally distributed, leaving one end of each molecule more positive than the other. Usually polar solvent has O-H bond of which water (HOH), (CH3OH) and acetic acid (CH3COOH) are examples. Propanol, butanol, formic acid, formamide are polar solvents. Dipolar solvents which contain a C-O solid bond without O-H bond are acetone [(CH3)2C=O], ethyl acetate (CH3COOCH2CH3), methyl ethyl ketone, acetonitrile, N,N-dimethylformamide and diemthyl sulfoxide. Nonpolar solvents, like carbon tetrachloride (CCl4), benzene (C6H6), and diethyl ether ( CH3CH2OCH2CH3), have molecules whose electric charges are equally distributed and are not miscible with water. Hexane, tetrahydrofuran and methylene chloride are non-polar solvents. Polar solvents are hydrophilic but non-polar solvents are lipophilic. Polar reactants will dissolve in polar solvents. Non-polar solvents dissolve non-polar compounds best. Oil and water don't mix but separate into two layers. There are three measures of the polarity as "dipole moment", "dielectric constant" and "miscibility with water". Though low dipole moments and small dielectric constants indicates non-polar solvents, sharp boundaries between polar and non-polar solvents are not available. The polarity reflects the balance between a polar component (OH) and a non-polar hydrocarbon component, existing in the same molecule. If hydrocarbon character increases relatively, the polarity decreases. On an operational basis, solvents that are miscible with water are polar.
Polar Protic and Dipolar Aprotic
Protic refers to a hydrogen atom attached to an electronegative atom. Protic solvents can donate an H+ (proton) since they contain dissociable H+, such as hydrogen attached to oxygen as in a hydroxyl group, nitrogen as in a amine group. Examples are water, methanol, ethanol, formic acid, hydrogen fluoride and ammonia. Aprotic solvents don't has O-H bond but a C=O bond typically. Examples are acetone [(CH3)2C=O] and ethyl acetate (CH3COOCH2CH3). Polar protic solvents are useful in SN1 reaction, while polar aprotic solvents are SN2 reaction.
|
|
|
|
|
Density (g/ml) |
|
Polar Protic |
||||
|
|
|
|
|
0.998 |
|
|
|
|
|
0.791 |
|
|
|
|
|
0.789 |
|
|
|
|
|
0.803 |
|
|
|
|
|
0.810 |
|
|
|
|
|
1.21 |
|
|
|
|
|
1.049 |
|
|
|
|
| 1.134 |
|
Polar Aprotic |
||||
|
|
|
|
|
0.786 |
|
|
|
|
|
0.886 |
|
|
|
|
|
0.805 |
|
|
|
|
|
0.894 |
|
|
|
|
|
0.786 |
|
|
|
|
|
0.944 |
|
|
|
|
|
1.092 |
|
Non-Polar |
||||
|
|
|
|
|
0.655 |
|
|
|
|
|
0.879 |
|
|
|
|
|
0.713 |
|
|
|
|
|
1.326 |
|
|
|
|
| 1.594 |